会员动态
USP亚硝胺新通则<1469>大局已定,来了解一下吧

美国药典(USP)拟定新通则
建议相关的原料药/制剂/辅料生厂商和供应商、合同制生产组织、药品检测和监管机构、QA/QC专家参考该通则。
USP
与FDA一样,USP
原料药工艺过程:原料、试剂、溶剂、加工助剂等
原料药降解物
溶剂降解物
来自于原料、溶剂(回收溶剂)、试剂、催化剂的杂质
来自于中间体和中间体生产带来的杂质
来自于水、辅料、加工助剂的杂质
制剂加工或包装材料引入或产生的杂质
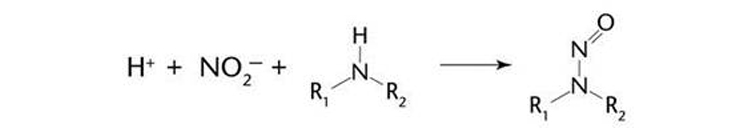
亚硝胺杂质的产生机理
此外USP
通则要求单个亚硝胺杂质不超过AI对应的限度,同时对检出浓度超过LOQ但不超过AI对应限度的多个杂质需咨询权威机构。笔者注:建议参考FDA的要求。
为了帮助供应商更好地检测亚硝胺杂质,USP
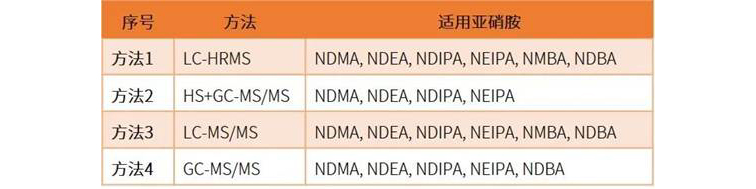
与EP 2.5.42仅限于原料药不同,USP
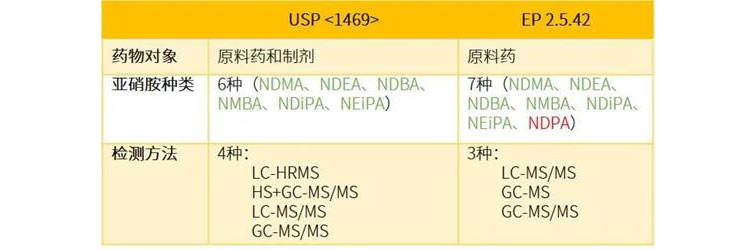
岛津可以为客户提供USP

关于USP
应用案例1
岛津海外应用工程师参考USP
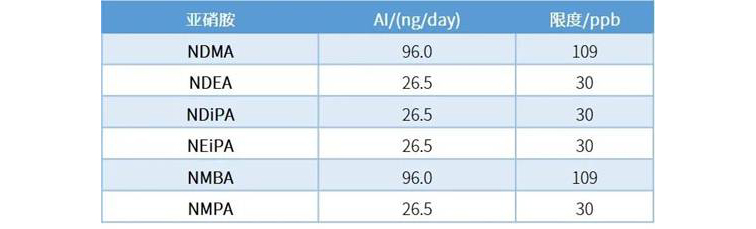
使用岛津HS-20和GC-MS/MS对方法进行研究,考察线性、准确度(回收率)、LOQ等参数,结果如下:
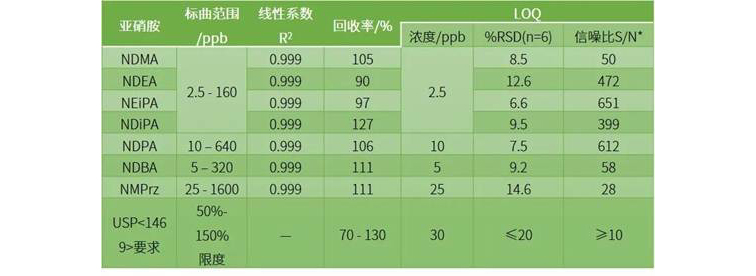
实验结果表明,岛津仪器性能超越了USP
应用案例2
参考
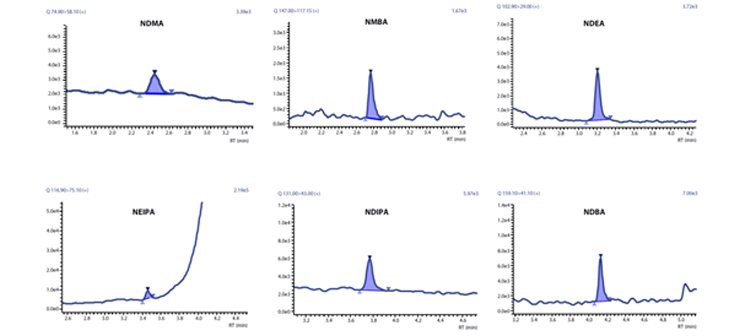
0.1ng/mL亚硝胺的MRM质量色谱图
数据展示:0.1 ng/mL 标准溶液的MRM色谱图如上图(该浓度是FDA要求的定量限值的 1/10)。在0.1 - 10 ng/mL浓度范围内的线性系数>0.99,该浓度范围内的精密度在80 - 120%,结果优异。
更多应用信息请联络岛津工作人员!



